研究为改善实体瘤中的T细胞治疗提供了潜在的策略
一种提供“一两拳”以帮助T细胞攻击实体瘤的新方法是宾夕法尼亚大学佩雷尔曼医学院研究人员临床前研究的重点。发表在《美国国家科学院院刊》(PNAS)上的研究结果显示,靶向控制炎症相关基因功能的两种调节因子导致模型中T细胞扩增至少10倍,从而增加抗肿瘤免疫活性和持久性。
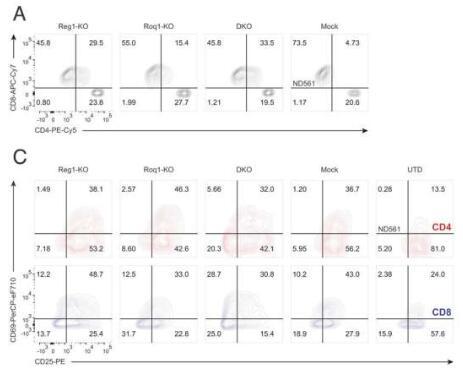
CAR T细胞疗法由宾夕法尼亚大学免疫治疗Richard W. Vague教授兼艾布拉姆森癌症中心细胞免疫治疗中心(CCI)主任Carl H. June博士在宾夕法尼亚大学医学部开创,他的工作导致了2017年第一个批准的用于B细胞急性淋巴细胞白血病的CAR T细胞疗法。从那时起,个性化细胞疗法彻底改变了血癌治疗,但对肺癌和乳腺癌等实体瘤仍然无效。
“我们希望为实体瘤患者解锁CAR T细胞疗法,其中包括最常见的癌症类型,”新研究的资深作者June说。“我们的研究表明,免疫炎症调节因子靶向值得进一步研究,以提高T细胞的效力。
实体瘤中CAR-T细胞疗法的挑战之一是称为T细胞耗竭的现象,其中来自实体瘤细胞块的持续抗原暴露使T细胞磨损到无法产生抗肿瘤反应的程度。对已经耗尽的患者进行CAR-T细胞治疗的T细胞进行工程设计,导致产品效果较差,因为T细胞不能充分增殖或记住它们的任务。
先前的观察性研究暗示炎症调节因子Regnase-1是间接克服T细胞衰竭影响的潜在靶标,因为它在T细胞中被破坏时会引起过度炎症 - 使它们恢复以产生抗肿瘤反应。该研究小组,包括主要作者David Mai,工程与应用科学学院的生物工程研究生,以及CCI T细胞工程实验室负责人Neil Sheppard,DPhil,假设同时针对相关但独立的Roquin-1调节因子可以进一步提高反应。
“这两个调节基因中的每一个都与限制T细胞炎症反应有关,但我们发现一起破坏它们比单独破坏它们产生更大的抗癌作用,”Mai说。“通过建立以前的研究,我们开始更接近在实体瘤背景下似乎很有希望的策略。
该团队使用CRISPR-Cas9基因编辑在健康供体T细胞中单独和一起敲除Regnase-1和Roquin-1,这两种不同的免疫受体目前正在I期临床试验中进行研究:中皮素靶向M5 CAR(mesoCAR)和NY-ESO-1靶向8F TCR(NYESO TCR)。两种工程化T细胞产品都没有靶向CD19,CD<>是大多数批准的CAR-T细胞疗法靶向的抗原,因为这种抗原不存在于实体瘤中。
在CRISPR编辑后,T细胞被扩增并注入实体瘤小鼠模型中,研究人员观察到,与单独禁用Regnase-10相比,双重敲除导致工程T细胞的数量至少是其1倍,并且增加了抗肿瘤免疫活性和工程T细胞的寿命。在一些小鼠中,它还导致淋巴细胞过度产生,引起毒性。
“CRISPR是完全消融Regnase和Roquin等靶基因表达的有用工具,从而产生清晰的表型,但是还有其他策略可以考虑将这项工作转化为临床环境,例如条件基因调控的形式,”Sheppard说。
“我们当然对通过敲除这两种非冗余蛋白质组合而释放的抗肿瘤效力印象深刻。在实体瘤研究中,我们经常看到CAR-T细胞的有限扩增,但如果我们能够使每个T细胞更有效,并将它们复制到更多的数量,我们预计T细胞疗法在攻击实体瘤方面有更好的机会。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【经典爱情小故事】爱情是人类永恒的主题,许多经典的爱情故事跨越时间与空间,成为人们心中不朽的篇章。这些...浏览全文>>
-
【经典爱情伤感语句】爱情,是世间最美好也最痛苦的情感之一。它让人沉醉,也让人心碎;让人渴望,也让人遗憾...浏览全文>>
-
【经典爱情名言名句】爱情,是人类情感中最深刻、最动人的一部分。无论是文学作品中的描写,还是现实生活中的...浏览全文>>
-
【经典爱情留言句子】在爱情中,一句温暖的留言往往能拉近彼此的距离,成为情感交流中最动人的部分。无论是初...浏览全文>>
-
【经典爱情空间说说】在现代人的情感表达中,爱情不仅仅是语言和行动的体现,更是一种空间的承载与寄托。许多...浏览全文>>
-
【经典爱情个性签名简短】在日常生活中,个性签名是表达情感、展现自我风格的一种方式。尤其在爱情中,一句简...浏览全文>>
-
【经典爱情个性签名】在当今的社交平台上,个性签名已经成为人们表达情感、展示自我风格的重要方式之一。而“...浏览全文>>
-
【经典爱情佛语】在佛教文化中,爱情并非仅仅是世俗情感的体现,更是一种修行与觉悟的过程。许多佛语蕴含着深...浏览全文>>
-
【劲酒的功效】劲酒是一种以中药为原料,结合传统酿造工艺制成的保健型白酒。它不仅具有普通白酒的饮用价值,...浏览全文>>
-
【劲红茶在哪里能买到正宗】“劲红茶在哪里能买到正宗”是许多消费者在选购茶叶时常常会提出的问题。劲红茶作...浏览全文>>
